|
|
Dr Philippe MEICLER
Gynécologue-obstétricien
Chirurgien gynécologue
Sommaire: 1) Méthodes 2) Indications
Assistance
Médicale à la Procréation
La fécondation consiste en la fusion d'un spermatozoïde, cellule sexuelle masculine venue du testicule, avec un ovocyte (ou ovule), cellule sexuelle féminine venue de l'ovaire. Leur réunion de ces cellules sexuelles ou gamètes forme l'embryon. Le spermatozoïde est amené par un rapport sexuel. Normalement, lors d'un rapport, plusieurs centaines de millions de spermatozoïdes sont déposés au fond du vagin. Une petite partie va franchir le col de l'utérus et remonter vers les orifices des trompes. Quelques centaines seulement pénètrent dans les trompes et y demeurent fécondants plusieurs jours. L'ovule expulsé par l'ovaire au moment de l'ovulation est capté par la trompe située du même coté. Dans la trompe, sa survie est très brève, de l'ordre de quelques heures. La fécondation naturelle à lieu dans la trompe : les spermatozoïdes, peuvent être là depuis plusieurs jours, alors que l'ovule ne peut attendre plus de quelques heures. L'assistance Médicale à la Procréation peut intervenir de deux manières :
Elle utilise le sperme du conjoint (insémination intra-conjugale) ou d'un donneur. Insémination intra-cervicale Le sperme est simplement déposé dans la glaire à l'aide d'une canule. Divers artifices (cupules, dômes) permettent de prolonger le contact et de protéger les spermatozoïdes de l'acidité vaginale. L'insémination doit avoir lieu juste avant l'ovulation :
Résultats Toutes les statistiques concernant l'insémination cervicale intra-conjugale sont anciennes, car depuis 1985 la méthode a tendance à être abandonnée dans la routine clinique au profit de l'IIU, réputée donner de meilleurs résultats. Elle est pourtant très efficace lorsqu'elle vise simplement à corriger un défaut de rencontre alors que la glaire, le sperme et l'ovulation sont normaux. Les taux de grossesse sont de l'ordre de 15 à 20 % par cycle dans cette indication rare. Ils tournent en revanche autour de 4 % lorsque l'indication est une qualité du sperme insuffisante. L'IAD en cycle spontané donne un taux de grossesse de 8,8 % en moyenne (CECOS 1996).
Indications
Les résultats de l'insémination intra-utérine dépendent de très nombreux facteurs : l'indication, l'âge de la femme, le rang de la tentative, le type de stimulation ovarienne si elle est associée, le monitorage du cycle et la chronologie de l'insémination par rapport à l'ovulation, la méthode de préparation du sperme, la qualité du sperme avant et après préparation, le nombre de spermatozoïdes injectés, etc. Il en résulte une extrême diversité des résultats. Dans les séries contrôlées, toutes indications confondues, les taux de grossesses vont de 0 à 23 % par cycle, avec une moyenne aux alentours de 8 % par cycle. Les meilleurs résultats sont obtenus dans les stérilités cervicales (15 %) et les stérilités sans cause (13 %). En revanche, les résultats sont mauvais dans les indications masculines (5 %). Ces chiffres sont des moyennes obtenues par compilation de la littérature. Ils n'ont qu'une valeur indicative car les techniques, les stimulations et les critères pour définir les indications, notamment masculines, sont très disparates. Avec une stimulation poly-ovulante, les taux de grossesse sont le plus souvent aux alentours de 15 à 18 % par cycle, avec 20 % de grossesses multiples, dont un nombre imprécis de triples, jusqu'à 6 % dans certaines statistiques. Avec une stimulation mono-ovulante, il est possible d'obtenir un taux de grossesses d'environ 12 % par cycle, en évitant les complications : aucune hyper-stimulation, gémellaires (Moins de 5 %), triple exceptionnelles. Un point remarquable est que la quasi-totalité des grossesses sont obtenues au cours des quatre à six premiers cycles d'IIU. En cas d'échec, il n'est donc pas recommandé d'aller au-delà. La supériorité de l'IIU par rapport à l'insémination intra-cervicale, même dans les cas où il n'existe aucune anomalie de la glaire, a été démontrée dans le modèle que constitue le don de sperme, avec des taux de grossesse par cycle de 19,4% après IIU-D contre 6,7% après IAD intra-cervicale
La fécondation in vitro (FIV) classique consiste à réaliser l'union des gamètes hors du tractus génital féminin, en les mettant simplement en présence l'un de l'autre dans un milieu de culture. L'embryon obtenu est transféré in utero ou congelé. Technique
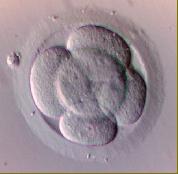
Stimulation des ovaires La FIV pourrait être réalisée en cycle spontané à la condition qu'il soit normal. L'avantage serait une relative simplicité rendant possible la répétition des tentatives d'un mois sur l'autre. Mais la méthode est inutilisable chez les patientes dont l'ovulation est anormale ou absente. En outre, la fécondation d'un seul ovocyte donne des résultats très inégaux et le plus souvent les résultats sont largement inférieurs à ceux des cycles stimulés. Pour toutes ces raisons, auxquelles se joint en France la limitation du nombre de FIV prises en charge par l'assurance maladie, la FIV en cycle spontané est devenue l'exception. Les ovaires sont donc stimulés afin d'obtenir le développement de plusieurs follicules. L'objectif est de recueillir un nombre suffisant d'ovocytes matures pour être aussi certain que possible d'avoir des embryons à transférer. Le taux moyen de fécondation étant de l'ordre de 60 %, il est souhaitable d'avoir au moins quatre à cinq ovules fécondables pour espérer disposer de deux ou trois embryons. Les protocoles de stimulation les plus utilisés associent les gonadotrophines (PUREGON, GONAL-F, MENOGON, ...) aux analogues de la GnRH. Le principal intérêt des analogues est d'éviter le déclenchement spontané de l'ovulation, qui survient sans eux dans au moins 15 % des cycles, obligeant le plus souvent à l'abandon. Ils permettent aussi la programmation des ponctions. Exemples d'analogues de la LHRH : DECAPEPTYL, ENANTONE,... Depuis peu de temps, on dispose d'un nouveau type de molécule : les antagonistes de la LHRH (type CETROTIDE) qui empêchent également le déclenchement spontané de l'ovulation. La stimulation ovarienne nécessite un monitorage précis, associant dosages hormonaux (stradiol, éventuellement LH et progestérone) et échographies, pour diriger la croissance des follicules, décider du déclenchement par hCG, et diminuer les risques d'hyperstimulation. Finalement, quand au moins deux follicules sont arrivés à maturité, l'ovulation est déclenchée par une injection d'hCG. La ponction folliculaire doit avoir lieu avant la rupture folliculaire, qui surviendra sinon 40h environ après le déclenchement. Recueil et préparation des gamètes Ovocytes Les ovocytes sont obtenus par ponction folliculaire environ 36h après déclenchement par hCG. La ponction est le plus souvent échoguidée, par voie transvaginale, sous anesthésie générale ou locale avec prémédication. Les complexes cumulo-ovocytaires sont isolés du liquide folliculaire, mis dans un milieu de culture et conservés dans une étuve à 37°C sous atmosphère de 5% de CO2 dans l'air. Spermatozoïdes Le recueil et la préparation des spermatozoïdes sont effectués dans le même temps. Fécondation in vitro et culture embryonnaire Les ovocytes sont mis en contact avec les spermatozoïdes quelques heures après la ponction, pour laisser à leur maturation le temps de se compléter. Le nombre de spermatozoïdes utilisés va de quelques milliers à plusieurs dizaines de milliers selon le volume de milieu de culture utilisé. La préparation est remise à l'étuve. Au bout de 17h environ, les ovocytes sont débarrassés des cellules qui les entourent, ce qui permet leur observation directe. A ce stade, deux noyaux (les " pronuclei ") sont ordinairement visibles, l'un étant celui de l'ovocyte, l'autre correspondant à la tête du spermatozoïde, attestant ainsi de la fécondation. Les ovules ayant plus de deux pronuclei (polypsermie) sont éliminés à ce stade car, bien que non viables, ils peuvent cliver normalement et seront ultérieurement impossible à distinguer des embryons normaux. Les autres sont remis à l'étuve. Au bout de 24h, une nouvelle observation retrouve les embryons au stade de deux à quatre cellules et permet de les classer, habituellement en quatre types A,B,C ou D. Transfert embryonnaire Transfert immédiat Les embryons sont habituellement transférés dès l'obtention des premières divisions, c'est-à-dire le surlendemain de la ponction, éventuellement un jour plus tard. Au-delà, le milieu de culture utilisé pour la FIV n'est plus adéquat pour assurer leur croissance. Les embryons sont placés dans la cavité utérine à l'aide d'une fine canule. Le geste est ambulatoire (pas d'hospitalisation). Les embryons de type A et B, dont les taux d'implantation sont équivalents, sont utilisés en priorité, car ils donnent les meilleures chances de grossesse. Dans ce cas, un à deux embryons seulement sont replacés pour éviter le risque de grossesse multiple et les embryons A et B restants sont congelés. Les embryons de type C et D donnent peu de grossesses et ne résistent pas à la congélation. Ils ne sont donc utilisés que par défaut et à l'état frais. Transfert retardé (culture prolongée) Le transfert peut être plus tardif, cinq à six jours après la fécondation, si les embryons sont gardés en culture jusqu'au stade blastocyste. Ces cultures prolongées nécessitent le recours à des milieux spéciaux. L'avantage du transfert au stade blastocyste est de permettre un contrôle du début de la croissance embryonnaire, stade critique du développement où surviennent de nombreux arrêts. Les blastocystes ont un meilleur taux d'implantation. Cette sélection des embryons permet de n'en transférer qu'un ou deux pour réduire le taux de grossesses multiples. Transfert différé Les embryons non transférés à l'état frais peuvent être conservés par congélation, en vue d'un replacement ultérieur, à la condition toutefois qu'ils soient d'une qualité suffisante (types A et B). Eclosion assistée (Hatching) Le hatching consiste à fragiliser la coque de l'uf (la zone pellucide) soit chimiquement, soit mécaniquement, en la fendant à l'aide d'une pipette ou d'un rayon laser. Le but est de favoriser l'éclosion du blastocyste. Les indications du hatching sont encore imparfaitement définies. Il semble intéressant en cas de pellucide épaisse, d'échecs répétés d'implantation, et aussi chez les patientes de plus de 37 ans avec une FSH élevée. Soins après transfert Le transfert est suivi d'un traitement d'une durée de 15 jours, associant de la progestérone (Utrogestan® 400 mg par jour sous la forme de comprimés à utiliser par voie vaginale ou par voie orale (la progestérone, hormone de la grossesse, a tendance à faire dormir, et cet effet est moins marqué par voie vaginale, qui est donc préférable) et de l'hCG à raison d'une à deux injections de 1500 UI dans la semaine qui suit le transfert. L'injection d'hCG est contre-indiquée s'il existe un risque d'hyperstimulation connu (stradiol >3000 pg/mL le jour du déclenchement, ovaires micro-polykystiques) ou dépisté par l'examen clinique et éventuellement échographique (gros ovaires douloureux, ballonnement, épanchement intra-abdominal). Diagnostic et surveillance du début de la grossesse La grossesse débutante, dont le premier signe est la persistance de l'aménorrhée (non apparition des règles), est affirmée par le dosage d'hCG vers le 15ème jour après la ponction. Ce dosage doit être systématique, car bon nombre de grossesses FIV s'accompagnent d'hémorragies au début, qu'elles soient pathologiques (implantations fugaces, avortements spontanés, grossesses extra utérines) ou finalement évolutives. Une échographie, faite dès la 4ème semaine de grossesse, permet le contrôle de l'évolutivité et le dépistage précoce des grossesses multiples et ectopiques. Indications Indications absolues Du côté féminin, la FIV est la seule technique utilisable en cas de stérilité tubaire définitive : trompes obturées et inopérables (lésions plurifocales, échec d'intervention antérieure, tuberculose), trompes absentes après salpingectomie pour grossesse extra-utérine, lésions infectieuses ou endométriose. Du coté masculin, la FIV classique est indiquée en cas d'insuffisance spermatique si le nombre de spermatozoïdes recueillis au test TMS est compris entre 300 000 et 500 000, avec une survie positive à 24h. Indications relatives Le recours à la FIV peut être envisagé, soit d'emblée, soit secondairement, après échec des autres thérapeutiques, dans toutes les formes de stérilité conjugale : stérilités tubaires relatives (trompes perméables mais altérées), cervicales, par endométriose, par troubles de l'ovulation, avec DES-syndrôme, stérilités immunologiques, insuffisances spermatiques avec TMS > 0,5 million, échecs d'inséminations intra-utérines intraconjugales ou avec donneur , stérilités idiopathiques. Résultats Environ 10 % environ des embryons produits par fécondation in-vitro s'implantent après transfert intra-utérin. Le transfert d'un seul embryon donne donc environ 10 % de grossesse, celui de deux embryons 20 %, etc. Les raisons qui expliquent que 90 % des embryons ne s'implantent pas sont loin d'êtres élucidées : la mauvaise qualité embryonnaire semble être le facteur principal ; les modalités du transfert jouent un rôle important : difficulté à franchir le col, saignements, douleurs. En revanche, le rôle d'anomalies de l'implantation proprement dites n'est pas clairement documenté, hormis les cas où il existe une pathologie endo-utérine : inflammation (endométrite), polypes, fibromes sous-muqueux, synéchies.. Globalement, 10 à 15 % des cycles de FIV classique aboutissent à une naissance, 20 à 25 % des grossesses se terminent par un avortement spontané, et 2 à 5 % sont ectopiques (Grossesse extra-utérine G.E.U.). Les chances de succès dépendent principalement de trois facteurs : l'indication , le nombre d'embryons transférés et l'âge de la femme. Les meilleurs taux de succès sont obtenus dans la stérilité tubaire pure, où l'objectif est simplement de court-circuiter un obstacle mécanique en l'absence de toute anomalie biologique au niveau des gamètes. Les résultats sont bien moins bons en cas de stérilité masculine, dépendant de la nature et du degré de l'insuffisance spermatique. Toutes indications confondues, le taux de grossesse chute rapidement à partir de 37 ans. Après 40 ans, 4 à 5 % seulement des tentatives aboutissent à une naissance. Les naissances sont exceptionnelles après 44 ans. C'est la baisse du nombre et de la qualité des ovocytes qui explique les effets délétères de l'âge maternel. Pour la même raison, les résultats de la FIV sont étroitement corrélés avec les taux de FSH, d'stradiol et d'inhibine mesurés au troisième jour du cycle, reflet plus informatif de la fonction ovarienne que l'âge calendaire. Pour limiter les risques de grossesse hautement multiples (triple ou plus), la plupart des équipes ne transfèrent que deux ou trois embryons frais, et conservent le surplus par congélation.
Stimulation des ovaires ET Recueil et préparation des gamètes idem FIVETE Ovocytes Les ovocytes sont recueillis de la même façon que pour la FIV classique, c'est-à-dire habituellement par ponction folliculaire transvaginale échoguidée 36h après le déclenchement par hCG. Les ovocytes sont immédiatement débarrassés des cellules qui les entourent : c'est la décoronisation. Après décoronisation, la qualité des ovocytes peut être définie précisément : ovocyte mûr (il est dit " en métaphase II " ou " M2 "), ovocytes immatures à divers stades, pellucides vides, c'est-à-dire ovocytes vidés de leur contenu à la suite d'une rupture de leur paroi (la " zone pellucide "). Les ovocytes décoronisés sont placés dans un milieu de culture et conservés dans une étuve à 37°C sous atmosphère de 5% de CO2 dans l'air. Seuls les ovocytes mûrs sont immédiatement micro-injectables. Les autres peuvent éventuellement le devenir après un temps de maturation in vitro, mais donneront peu de grossesses. Spermatozoïdes Les spermatozoïdes frais ou congelés de toute origine (éjaculat, prélèvement chirurgical) peuvent êtres utilisés dans l'ICSI, pourvu qu'ils soient vivants. Après préparation selon les techniques déjà décrites , ils sont placés dans une solution de polyvinyl-pyrrolidone (PVP) qui les immobilise par sa viscosité. Un seul spermatozoïde mobile est chargé dans la micro-pipette, après cassure du flagelle pour lui enlever toute possibilité de mouvement à l'intérieur de l'ovule. Spermatides L'ICSI peut aussi être réalisée avec des spermatides prélevées dans le testicule à divers stades de leur développement : spermatide ronde (ROS = Round Spermatid), ou spermatide allongée. Microinjection et culture embryonnaire La micro-injection est réalisée à l'aide d'un micro-manipulateur, appareillage complexe qui comprend deux bras : l'un tient une pipette de contention servant à immobiliser l'ovocyte par aspiration contre son extrémité mousse ; l'autre tient la micro-pipette de ponction. ICSI La micro-pipette, chargée d'un seul spermatozoïde, est introduite dans l'ovule, qui est aspiré en partie pour vérifier la pénétration, puis refoulé à sa place en même temps que le spermatozoïde. La préparation est remise à l'étuve. Le lendemain matin, au bout de 17 heures environ, un nouvel examen permet de repérer les deux pronuclei, l'un des noyaux étant celui de l'ovocyte, l'autre correspondant à la tête du spermatozoïde injecté. Certains ovocytes se détruisent après la micro-manipulation : on dit qu'il " s'atrésient ". Le surlendemain, les embryons, au stade de deux à quatre cellules, sont classés comme habituellement en quatre types. ROSI-ROSNI L'utilisation de spermatides est une pratique marginale et encore expérimentale. L'ensemble de la cellule peut être injectée dans le cytoplasme ovulaire (ROSI = Round Spermatid Injection) ou seulement son noyau (ROSNI = Round Spermatid Nuclear Injection). Les dernières étapes de la procédure (transfert embryonnaire, phase lutéale, diagnostic et surveillance de la grossesse) sont semblables à celles de la FIV classique. Indications Indications absolues
Indications relatives
Comme pour la fécondation in vitro classique, les résultats de l'ICSI dépendent principalement de l'indication, du nombre d'embryons transférés, et l'âge de la femme. Les meilleurs taux de succès sont obtenus dans la stérilité masculine pure, où l'objectif est simplement de court-circuiter les obstacles que constituent la pellucide et la paroi cytoplasmique de l'ovocyte, obstacles que les spermatozoïdes sont incapables de franchir lorsque leur nombre, leur mobilité ou leur morphologie sont trop anormales. Les résultats ne sont pas influencés par la sévérité ou l'association de plusieurs types d'anomalies : oligospermie, asthénospermie ou tératospermie. La situation est plus complexe pour une forme particulière de tératospermie monomorphe, la globozoospermie, qui correspond à une absence totale d'acrosome. Dans certains cas, l'ICSI est capable d'obtenir la naissance d'un enfant normal. Dans d'autre, la fécondation est impossible, apparemment par défaut d'activation de l'ovocyte. La naissance d'un enfant normal a pu être obtenue en activant l'ovocyte par un ionophore calcique mais cette observation est isolée et l'innocuité de la méthode non établie. Finalement, le nombre de spermatozoïdes nécessaires étant infime, il n'y a presque plus de limites masculines à l'ICSI avec cependant un risque pour l'instant non évalué : celui de transmettre à l'enfant une anomalie chromosomique ou génique à l'origine de la stérilité. Les résultats sont, en revanche, beaucoup moins bons s'il existe des facteurs féminins altérant la qualité ovulaire. C'est par ce biais qu'intervient l'âge de la femme qui constitue en fait la principale limite à l'ICSI. Compte tenu de la lourdeur de la procédure, l'évaluation préalable de la fonction ovarienne prend un intérêt tout particulier. Les indications et l'innocuité de l'injection de spermatides sont discutées. Pour certains , les blocages de la spermatogenèse se font toujours en amont du stade spermatide, et la découverte de spermatides rondes dans le testicule signifie qu'il existe quelque part de minimes foyers de spermatogenèse qu'il faut s'acharner à retrouver. FIV classique Ce sont les échecs de fécondation qui étaient nombreux avant l'apparition de l'ICSI en 1994. La situation s'est améliorée depuis car la FIV classique n'est plus employée en cas d'insuffisance spermatique importante. ICSI Les échecs de fécondation sont rares : 6%. Il s'agit essentiellement d'échecs d'origine féminine : patientes âgées avec recueil d'un petit nombre d'ovocytes mûrs. Il apparaît clairement que les résultats de l'ICSI sont meilleurs que les résultats de la FIV classique. Il ne faut pas en déduire que l'ICSI est une meilleure technique. En effet, la différence est due non pas à la technique elle même mais au fait que les cas traités ne sont pas les mêmes. Utiliser l'ICSI pour les couples qui relèvent de la FIV classique n'améliore pas leurs résultats, comme cela a été démontré par plusieurs études contrôlées. Les résultats globaux correspondent à des moyennes statistiques elles sont valable pour l'ensemble de la population traitée. Au niveau du couple, les chances dépendent principalement de trois facteurs :
Résultats en fonction de l'indication
Ce sont les causes pour laquelle la FIV a été entreprise. Il peut s'agir de stérilité féminine, masculine, mixte ou " inexpliquée ". Stérilité féminine Stérilités par obstacle mécanique (trompes obturées ou absente) : il s'agit simplement de contourner un obstacle alors que les ovocytes et le sperme sont normaux. Il n'y a pas d'anomalie biologique qui s'oppose à la fécondation. Les résultats sont bons. Stérilité fonctionnelle : il s'agit en général d'anomalies de l'ovulation non résolues hors FIV. Les résultats sont plus aléatoires car la qualité des ovocytes est moins assurée. Stérilité masculine En cas d'insuffisance spermatique, les échecs de fécondation sont fréquents. Les taux de grossesses par ponction sont faibles. En revanche, si la fécondation a réussi et que des embryons sont obtenus, les taux de grossesse par transfert sont aussi bons que dans la stérilité tubaire. Lorsque le nombre de spermatozoïdes disponibles est inférieur à 300 000, il faut passer à l'ICSI. Stérilité inexpliquée Il n'y a évidemment pas de stérilité " sans cause ", mais la cause n'a pas été retrouvée. Cette indication correspond à des cas forcément hétérogènes. Les résultats sont intermédiaires, moins bons que pour les stérilités mécaniques, mais meilleurs que pour les stérilités masculine.
Résultats en fonction du nombre d'embryons transférés
Environ 10% des embryons obtenus in vitro sont viables, c'est-à-dire capable de s'implanter et de donner une grossesse évolutive. Le transfert de plusieurs embryons augmente les chances de grossesses, mais fait courir parallèlement un risque de grossesse multiple :
Ce tableau montre que la grossesse multiple est un risque majeur de la FIV :
Résultats en fonction de l'age de la femme
Accouchements / Ponction
Accouchements/ Transfert
La congélation des embryons humains a bénéficié de l'expérience acquise chez l'animal, où elle est depuis longtemps entrée dans la routine. Technique Les embryons peuvent êtres congelés dès le lendemain de la FIV, au stade de deux pronuclei, ou lors les premières divisions, s'ils sont de type A ou B, et enfin au stade blastocyste. La conservation se fait dans des paillettes contenant un ou plusieurs embryons dans un liquide de culture additionné de cryoprotecteur. Les paillettes scellées et identifiées sont congelées à l'aide d'un appareil programmable permettant de faire descendre la température par paliers successifs de façon automatique ou semi-automatique. Les paillettes sont ensuite stockées dans l'azote liquide (-196°C). Les cryoprotecteur utilisé et les protocoles de refroidissement varient selon le stade de développement embryonnaire. Le transfert des embryons congelés se fait en cycle spontané, en cycle stimulé (stimulation mono-ovulante) ou encore en cycle artificiel (oestro-progestatifs séquentiels). En cas d'ovulation spontanée ou provoquée, le transfert a lieu en début de phase lutéale, schématiquement au même moment par rapport au pic de LH ou à l'injection déclenchante d'hCG qu'un transfert d'embryons frais. La décongélation des paillettes consiste simplement à les ramener en quelques minutes à 37°C par immersion dans des bains successifs de milieu de culture. Elle peut se faire dans les heures qui précèdent le transfert, ou la veille pour observer la reprise du développement, dont l'absence n'empèche pas le replacement, car elle peut être suivie de grossesse évolutive. Indications La congélation s'adresse aux embryons qui ne peuvent êtres transférés immédiatement, soit que leur nombre dépasse le contingent acceptable, deux ou trois habituellement, soit qu'il existe un risque d'hyperstimulation qui contre-indique un transfert immédiat. Dans ce dernier cas, tous les embryons sont congelés et replacés dans un ou plusieurs cycles ultérieurs. Résultats Environ 80 % des embryons de type A et B résistent à la congélation et sont transférables. Les résultats sont très inégaux suivant les centres, probablement pour des raisons techniques. En moyenne, les taux d'implantation se situent aux alentours de 5 % par embryon décongelé transféré, mais certaines équipes obtiennent des résultats équivalant aux transferts d'embryons frais. |